Reaksi-Reaksi Spesifik pada Protein
A. Protein

 (Hart, 2003).
(Hart, 2003).
Protein (asal kata protos dari bahasa Yunani yang berarti "yang paling utama") adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomerasam amino yang dihubungkan satu sama lain dengan ikatan peptida. Molekul protein mengandung karbon, hidrogen, oksigen, nitrogen dan kadang kala sulfur serta fosfor. Protein berperan penting dalam struktur dan fungsi semua sel makhluk hidup dan virus.
Kebanyakan protein merupakan enzim atau subunit enzim. Jenis protein lain berperan dalam fungsi struktural atau mekanis, misalnya protein yang membentuk batang dan sendi sitoskeleton. Protein terlibat dalam sistem imun sebagai antibodi, sistem kendali dalam bentuk hormon, sebagai komponen penyimpanan (dalam biji) dan juga dalam transportasi hara. Sebagai salah satu sumber gizi, protein berperan sebagai sumber asam amino bagi organisme yang tidak mampu membentuk asam amino tersebut (heterotrof).
Protein merupakan salah satu dari biomolekul raksasa, selain polisakarida, lipid, dan polinukleotida, yang merupakan penyusun utama makhluk hidup. Selain itu, protein merupakan salah satu molekul yang paling banyak diteliti dalam biokimia. Protein ditemukan oleh Jöns Jakob Berzelius pada tahun 1838.
Biosintesis protein alami sama dengan ekspresi genetik. Kode genetik yang dibawa DNA ditranskripsi menjadi RNA, yang berperan sebagai cetakan bagi translasi yang dilakukan ribosom.Sampai tahap ini, protein masih "mentah", hanya tersusun dari asam amino proteinogenik. Melalui mekanisme pascatranslasi, terbentuklah protein yang memiliki fungsi penuh secara biologi.
B. Struktur Protein
Struktur protein dapat dilihat sebagai hierarki, yaitu berupa struktur primer (tingkat satu), sekunder (tingkat dua), tersier (tingkat tiga), dan kuartener (tingkat empat):[4][5]
- struktur primer protein merupakan urutan asam amino penyusun protein yang dihubungkan melalui ikatan peptida (amida). Frederick Sangermerupakan ilmuwan yang berjasa dengan temuan metode penentuan deret asam amino pada protein, dengan penggunaan beberapa enzim protease yang mengiris ikatan antara asam amino tertentu, menjadi fragmen peptida yang lebih pendek untuk dipisahkan lebih lanjut dengan bantuan kertas kromatografik. Urutan asam amino menentukan fungsi protein, pada tahun 1957, Vernon Ingram menemukan bahwa translokasi asam amino akan mengubah fungsi protein, dan lebih lanjut memicu mutasi genetik.
- struktur sekunder protein adalah struktur tiga dimensi lokal dari berbagai rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen. Berbagai bentuk struktur sekunder misalnya ialah sebagai berikut:
- alpha helix (α-helix, "puntiran-alfa"), berupa pilinan rantai asam-asam amino berbentuk seperti spiral;
- beta-sheet (β-sheet, "lempeng-beta"), berupa lembaran-lembaran lebar yang tersusun dari sejumlah rantai asam amino yang saling terikat melalui ikatan hidrogen atau ikatan tiol (S-H);
- beta-turn, (β-turn, "lekukan-beta"); dan
- gamma-turn, (γ-turn, "lekukan-gamma").[4]
- struktur tersier yang merupakan gabungan dari aneka ragam dari struktur sekunder. Struktur tersier biasanya berupa gumpalan. Beberapa molekul protein dapat berinteraksi secara fisik tanpa ikatan kovalen membentuk oligomer yang stabil (misalnya dimer, trimer, atau kuartomer) dan membentuk struktur kuartener.
- contoh struktur kuartener yang terkenal adalah enzim Rubisco dan insulin.
Struktur primer protein bisa ditentukan dengan beberapa metode: (1) hidrolisis protein dengan asam kuat (misalnya, 6N HCl) dan kemudian komposisi asam amino ditentukan dengan instrumen amino acid analyzer, (2) analisis sekuens dari ujung-N dengan menggunakan degradasi Edman, (3) kombinasi dari digesti dengan tripsin dan spektrometri massa, dan (4) penentuan massa molekular dengan spektrometri massa.
Struktur sekunder bisa ditentukan dengan menggunakan spektroskopi circular dichroism (CD) dan Fourier Transform Infra Red (FTIR).Spektrum CD dari puntiran-alfa menunjukkan dua absorbans negatif pada 208 dan 220 nm dan lempeng-beta menunjukkan satu puncak negatif sekitar 210-216 nm. Estimasi dari komposisi struktur sekunder dari protein bisa dikalkulasi dari spektrum CD. Pada spektrum FTIR, pita amida-I dari puntiran-alfa berbeda dibandingkan dengan pita amida-I dari lempeng-beta. Jadi, komposisi struktur sekunder dari protein juga bisa diestimasi dari spektrum inframerah.
Struktur protein lainnya yang juga dikenal adalah domain. Struktur ini terdiri dari 40-350 asam amino. Protein sederhana umumnya hanya memiliki satu domain. Pada protein yang lebih kompleks, ada beberapa domain yang terlibat di dalamnya. Hubungan rantai polipeptida yang berperan di dalamnya akan menimbulkan sebuah fungsi baru berbeda dengan komponen penyusunnya. Bila struktur domain pada struktur kompleks ini berpisah, maka fungsi biologis masing-masing komponen domain penyusunnya tidak hilang. Inilah yang membedakan struktur domain dengan struktur kuartener. Pada struktur kuartener, setelah struktur kompleksnya berpisah, protein tersebut tidak fungsional.
Kenyataannya, seluruh protein yang ada di dunia ini merupakan kombinasi dari dua puluh macam asam amino, baik esensial maupun non esensial.
C. Reaksi Spesifik Protein
- Reaksi Xantoprotein. Untuk mendapatkan reaksi ini, perlu penambahan larutan asam nitrat yang pekat ke dalam larutan protein. Pada saat dicampur, akan terlihat pembentukan endapan berwarna putih yang apabila dipanaskan akan berubah warna menjadi kekuningan. Reaksi ini terjadi pada protein yang di dalamnya terkandung senyawa antara lain fenilalanin, triptofan, dan juga tirosin.
- Reaksi sakaguchi. Uji Sakaguchi adalah uji kimia yang digunakan untuk mendeteksi asam amino arginin. Arginin memiliki kelompok-R propil (3 metil) dengan gugus guanidin di ujungnya. Gugus guanidin merupakan atom C yang mengikat N2 dengan ikatan tunggal dan mengikat N dengan ikatan ganda. Gugus guanidin akan bereaksi dalam uji sakaguchi. Dalam kondisi basa, alpha naphtol akan bereaksi dengan gugus guanidin dalam arginin yang telah teroksidasi sodium hipoklorit, menghasilkan senyawa berwarna merah. Apabila protein yang diuji dengan tes sakaguchi menunjukkan perubahan warna merah berarti dalam protein tersebut terdapat arginin.
Struktur arginin
3, Uji ninhidrin
merupakan uji umum untuk protein yang spesifik untuk asam amino. Dalam percobaan kali ini menggunakan sampel MSG, aspartam, gelatin, susu skim dan putih telur. Dari data hasil praktikum di atas menunjukkan hasil yang berbeda-beda tiap sampel. Dengan percobaan ini dapat diketahui sampel mana yang positif mengandung protein dilihat dari ada atau tidaknya kandungan asam aminonya.
Percobaan pertama diawali dengan sampel MSG. Mula-mula MSG dimasukkan pada tabung reaksi sebanyak 2 ml menggunakan pipet volume, selanjutnya aspartam dimasukkan pada tabung reaksi sebanyak 2 ml menggunakan pipet volume. Selanjutnya gelatin dimasukkan pada tabung reaksi sebanyak 2 ml menggunakan pipet tetes. selanjutnya susu skim dimasukkan pada tabung reaksi sebanyak 2 ml menggunakan pipet volume, dan yang terakhir putih telur dimasukkan pada tabung reaksi sebanyak 2 ml menggunakan pipet volume. Kemudian masing-masing sampel ditambahkan ninhidrin sebanyak 2 ml. Kemudian secara bersamaan ke-lima sampel tersebut dimasukkan dalam gelas beker yang berisi air mendidih selama 15-20 detik. Kemudian secara bersamaan pula ke-lima sampel diangkat dari gelas beker. Selanjutnya diamati perubahan warna yang terjadi pada kelima sampel tersebut.
Dari percobaan yang telah dilakukan terdapat perubahan warna pada beberapa sampel yang diuji. Pada sampel MSG yang semula berwarna putih bening setelah dipanaskan warnanya berubah menjadi ungu pekat. Pada sampel aspartam yang semula berwarna putih setelah dipanaskan warnanya berubah menjadi bening dan terbentuk endapan putih. Pada sampel gelatin yang semula berwarna bening dan kental setelah dipanaskan warnanya berubah menjadi bening. Pada sampel susu skim yang semula berwarna bening setelah dipanaskan warnanya berubah menjadi ungu pudar. Pada sampel putih telur tidak ada perubahan warna pada saat sebelum dan sesudah dipanaskan, yakni tetap berwarna kuning bening.
Pada prinsip kerja uji ninhidrin ini, menguji ada atau tidaknya protein dalam suatu senyawa dengan penambahan reagen ninhidrin untuk mengetahui jumlah kadar asam amino bebas yang terkandung didalamnya, dimana asam amino bebas akan bereaksi dengan ninhidrin dan membentuk senyawa kompleks berwarna ungu. Sehingga, karena setelah dipanaskan warnanya berubah menjadi ungu maka pada sampel MSG dan susu skim positif mengandung asam amino. Sedangkan pada sampel yang lain yakni aspartam, gelatin dan putih telur hasilnya negatif karena setelah dipanaskan warnanya tidak berubah menjadi ungu atau pink. Hal ini dikarenakan mereka tidak memiliki asam amino bebas sehingga hasil uji reagen ninhidrinnya negatif. Pada aspartam seharusnya berwarna ungu karena terdiri dari ikatan asam aspartat dan fenil alanin, ketika dipanaskan kedua ikatan tersebut lepas dan menjadi asam amino bebas sehingga bisa diidentifikasi oleh ninhidrin (Hamid, 2007). Namun pada data hasil percobaan diatas, aspartam negatif tidak mengandung asam amino. Kesalahan dan ketidak tepatan hasil percobaan dengan literatur desebabkan antara lain karena terlalu lama didiamkan setelah ditambah ninhidrin dan air yang digunakan belum mendidih dengan sempurna
Pada MSG dan susu skim, warna ungu yang ditimbulkan MSG lebih pekat daripada susu skim. Hal ini menandakan bahwa MSG lebih banyak mengandung asam amino daripada susu skim. Semakin pekat warna ungu yang ditimbulkan maka semakin banyak asam amino yang terkandung didalamnya (Hamid, 2007).
Reaksi yang terjadi pada uji ninhidrin ini adalah :
Pada reaksi diatas ninhidrin ditambah asam alfa amino menghasilkan ninhidrin tereduksi dan NH3, karbondioksida dan gugus aldehidnya lepas ke lingkungan. Kemudian ninhidrin tereduksi dan NH3 ditambah ninhidrin baru diproses secara kondensasi menghasilkan garam diketo-hydrihalide-diketo-hydramine yang menyebabkan warna ungu (Hart, 2005).
4. Metode Lowry
Percobaan ini bertujuan untuk menentukan kadar protein dari larutan ubi ungu. Metode yang digunakan adalah metode lowry. Penentuan kadar protein dengan metode lowry didasarkan pada warna kompleks yang yang dibentuk yang intensitas warnanya bervariasi berasrkan jenisprotein atau jumlah asam amino aromatik pada protein. Warna yang timbul disebabkan oleh reaksi tembaga alkali dengan protein.
Reagen yang digunakan reagen Folin Ciocalteu yang merupakan campuran natrium tungstat dan natrium molibdat dalam asam. Campuran asam ini akan mereduksi protein yang digunakan dalam percobaan melalui penguraian Cu2+ sehingga campuran asam ini kehilangan satu atau lebih atom oksigen dan kompleks biru yang dihailkan merupakan kompleks antara protein dengan Cu2+.
Struktur kompleks biru :
Penentuan kuantitatif kadar protein secara lowry didasarkan pada absorbansi sinar oleh kompleks biru. Absorbansi diukur dengan menggunakan spektrofotometri UV-VIS. Absorbansi sampel yang diperoleh yaitu pada fraksi I adalah 0,57, fraksi II adalah 0,52, fraksi III adalah 0,4 dan fraksi IV adalah 0,37. untuk enzim kasar absorbansinya adalah 0,43. Kadar protein enzim murni pada fraksi I adalah 713,5 µg/ml, fraksi II adalah 651 µg/ml, fraksi III adalah 501 µg/ml, dan fraksi IV adalah 463,5 µg/ml. Pada ekstrak enzim kasar masih terdapat banyak protein sehingga kadarnya lebih tinggi.
Nilai aktivitas spesifik enzim α-amilase ekstrak kasar pada kelompok 1 adalah 0,089 dan pada kelompok 2 adalah 0,046. Nilai aktivitas spesifik enzim α-amilase pada enzim murni (pada kelompok 1 dan 2) adalah 0,039. Enzim murni yang digunakan adalah pada fraksi I karena nilai absorbansinya paling besar.
5. Uji biuret
merupakan uji umum untuk protein yang spesifik untuk ikatan peptida. Dalam percobaan kali ini menggunakan sampel MSG, aspartam, gelatin, susu skim dan putih telur. Dari data hasil praktikum di atas menunjukkan hasil yang berbeda tiap sampel. Dengan percobaan ini dapat diketahui sampel mana yang positif mengandung protein dilihat dari ada atau tidaknya ikatan peptida.
Percobaan pertama diawali dengan sampel MSG. Mula-mula MSG dimasukkan kedalam tabung reaksi sebanyak 3 ml menggunakan pipet volume, kemudian ditambah reagen NaOH 1 ml kemudian dikocok, setelah itu ditambahkan 3 tetes reagen CuSO4 menggunakan pipet tetes kemudian diamati perubahan warnanya. Sampel kedua yaitu aspartam, aspartam dimasukkan kedalam tabung reaksi sebanyak 3 ml menggunakan pipet volume, kemudian ditambah reagen NaOH 1 ml kemudian dikocok, setelah itu ditambahkan 3 tetes reagen CuSO4 menggunakan pipet tetes kemudian diamati perubahan warnanya. Sampel ketiga yaitu gelatin, gelatin dimasukkan kedalam tabung reaksi sebanyak 3 ml menggunakan pipet tetes, kemudian ditambah reagen NaOH 1 ml kemudian dikocok, setelah itu ditambahkan 3 tetes reagen CuSO4 menggunakan pipet tetes kemudian diamati perubahan warnanya. Sampel keempat yaitu susu skim, susu skim dimasukkan kedalam tabung reaksi sebanyak 3 ml menggunakan pipet volume, kemudian ditambah reagen NaOH 1 ml kemudian dikocok, setelah itu ditambahkan 3 tetes reagen CuSO4 menggunakan pipet tetes kemudian diamati perubahan warnanya. Terakhir sampel kelima yaitu putih telur, putih telur dimasukkan kedalam tabung reaksi sebanyak 3 ml menggunakan pipet volume, kemudian ditambah reagen NaOH 1 ml kemudian dikocok, setelah itu ditambahkan 3 tetes reagen CuSO4 menggunakan pipet tetes kemudian diamati perubahan warnanya.
Pada data hasil percobaan tersebut, MSG tidak berubah warna dari sebelum dan setelah direaksikan, yakni putih bening. Aspartam juga demikian, tidak mengalami perubahan warna dari sebelum dan setelah direaksikan, yakni putih. Namun berbeda dengan gelatin, susu skim dan putih telur. Gelatin yang semula berwarna bening kental, susu skim yang semula berwarna putih dan putih telur yang semula berwarna kuning bening, setelah direaksikan dengan reagen ketiganya berubah menjadi warna ungu pudar.
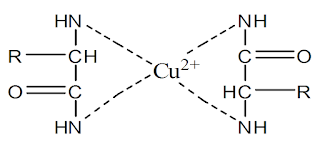
Pada prinsip kerja biuret, yaitu menguji ada atau tidak adanya protein dalam suatu senyawa dengan penambahan reagen NaOH dan CuSO4 berdasarkan ada atau tidaknya ikatan peptida (ikatan peptida harus 2 atau lebih). Dimana ion Cu2+ (dari pereaksi biuret) dalam suasana basa akan bereaksi dengan polipeptida yang menyusun protein dan membentuk senyawa kompleks berwarna biru hingga ungu (Azhar, 2010). Pada data percobaan diatas, MSG dan aspartam hasil ujinya adalah negatif, karena setelah direaksikan warnanya tidak berubah dan tidak membentuk warna ungu. Hal ini dikarenakan MSG tidak memiliki ikatan peptida, sedangkan aspartam hanya memiliki satu ikatan peptida (Hamid, 2007). Sedangkan pada gelatin, susu skim dan telur hasil ujinya adalah positif, karena setelah direaksikan dengan reagen pada permukaannya warnanya berubah menjadi ungu. Hal ini disebabkan karena ketiganya memiliki ikatan peptida lebih dari dua sehingga bisa diidentifikasi dalam uji biuret ini, dan hasil ujinya positif. Apabila warnanya ungu maka ikatan peptidanya panjang, apabila warnanya kemerahmudaan maka ikatan peptidanya pendek. Pada gelatin, susu skim dan putih telur sama-sama permukaannya berwarna ungu jadi ketiganya sama-sama memiliki ikatan peptida yang panjang (Hart, 2005). Reaksi yang terjadi pada uji biuret ini adalah :
6. Uji hopkins cole atau tes hopkins cole
merupakan uji kimia yang digunakan untuk menunjukkan adanya asam amino triptofan. Pereaksi yang dipakai mengandung asam glioksilat. Kondensasi 2 inti induk dari trptofan oleh asam glioksilat akan menghasilkan senyawa berwarna ungu. Reaksi positif ditunjukkan dengan adanya cincin ungu pada bidang batas.
Reaksi kondensasi merupakan penggabungan monomer-monomer menjadi polimer disertai dengan pelepasan molekul kecil seperti H2O, NH3, atau HCl.
Reaksi kondensasi merupakan penggabungan monomer-monomer menjadi polimer disertai dengan pelepasan molekul kecil seperti H2O, NH3, atau HCl.
 |
| Gambar 1. Triptofan |
Catatan:
Reaksi ini tidak berhasil apabila terdapat oksidator kuat seperti nitrat dan klorat. Asam sulfat yang digunakan harus sangat murni, yang tidak mengandung bahan-bahan yang dapat berperan sebagai oksidator.
Permasalahan
1. mengapa pada Uji hopkins Reaksi tidak berhasil apabila terdapat oksidator kuat seperti nitrat dan klorat?
2. Bagaimana prinsip kerja pada Pada uji ninhidrin?
3. Mengapa digunakan reagen CuSO4 pada uji biurret?
4. mengapa bila sampel berubah menjadi warna ungu maka ikatan peptidanya panjang pada uji biurret ?
4. mengapa bila sampel berubah menjadi warna ungu maka ikatan peptidanya panjang pada uji biurret ?


Saya akan menjawab nomor 3
BalasHapusFungsi CuSO4 adalah untuk membuat suasana larutan menjadi basa dan untuk menghasilkan senyawa kompleks berwarna ungu
Uji biuret ini mengandung CuSO4 jika dipanaskan akan membentuk kristal dan juga apabila dilakukan pemanasan, ikatan peptida dari sampel akan rusak dan tidak akan bisa dideteksi
Saya akan membantu menjawab permasalahan nomor 2
BalasHapusUji Ninhidrin dilakukan dengan menambahkan beberapa tetes larutan ninhidrin yang kemudian dipanaskan. Reaksi ini terjadi dengan senyawa amin primer dan ammonia tanpa pembebasan CO. Adanya protein atau asam amino ditunjukkan dengan terbentuknya warna ungu pada bahan uji .
Ninhidrin adalah suatu senyawa oksidator kuat yang apabila bereaksi dengan asam α amino akan menghasilkan warna ungu. Reaksi ini terjadi dengan senyawa amin primer dan ammonia tanpa pembebasan CO. Reaksi ninhidrin digunakan untuk mengetahui adanya kandungan asam α-amino.
Baiklah saudara hero saya akan mencoba menjawab permasalahan anda yang pertama , jadi Uji hopkins-cole digunakan untuk menunjukkan inti indol asam aminotriptofan yang ditandai dengan terbentuknya cincin berwarna ungu pada sampel percobaan. Jadi reaksi ini merupakan cara untuk menguji
BalasHapusada atau tidaknya asam amino triptofan pada bahan makanan. Prinsip uji hopkins cole adalah kondensasi inti indol dengan aldehid dimana jika terdapat asam kuat yang menyebabkan terbentuknya cincin ungu pada bidang atas. Tidak digunakannya oksidator kuat seperti nitrat dan klorat karena besar kemungkinannya tidak terbentuk cincin pada bidang atas.
Sehingga digunakan Asam sulfat yang digunakan harus sangat murni, yang tidak mengandung bahan-bahan yang dapat berperan sebagai oksidator.
saya akan menjawab permasalahan yang keempat
BalasHapusUji biuret ini dilakukan dengan tujuan untuk menentukan adanya senyawa – senyawa yang mengandung gugus amida asam. Reaksi biuret merupakan uji yang dilakukan untuk mengetahui ikatan peptida. Reaksi ini positif (berwarna ungu) untuk zat yang mengandung 2 atau lebih ikatan peptida.
Reaksi biuret merupakan reaksi warna yang umum untuk gugus peptida (-CO-NH-) dan protein. Reaksi positif ditandai dengan terbentuknya warna ungu karena terbentuk senyawa kompleks antara Cu2+ dan N dari molekul ikatan peptida. Banyaknya asam amino yang terikat pada ikatan peptida mempengaruhi warna reaksi ini. Senyawa dengan dipeptida memberikan warna biru, tripeptida ungu dan tetrapeptida serta peptida kompleks memberikan warna merah. Biuret dihasilkan dengan memanaskan urea kira-kira pada suhu 180 oC dalam larutan basa. Biuret memberikan warna violet dengan CuSO4. Reaksi ini disebut dengan reaksi biuret, kemungkinan terbentuknya Cu2+ dengan gugus CO dan –NH dari rantai peptida dalam suasana basa. Dipeptida dan asam-asam amino (kecuali histidina, serina dan treonina) tidak memberikan uji ini. Beberapa protein yang mempunyai gugus –CS-NH-, -CH-NH- dalam molekulnya juga memberikan tes warna positif dengan biuret.