Reaksi Senyawa Organologam (Analisis Kondisi dan Produk)
Senyawa Organologam
Senyawa organologam merupakan senyawa dimana minimal terdapat satu atom
karbon dari gugus organik yang berikatan langsung dengan logam. Istilah
organologam biasanya didefinisikan agak longgar, dan senyawa yang
mengandung ikatan karbon dengan fosfor, arsen, silikon, ataupun boron termasuk
dalam katagori ini. Tetapi untuk senyawa yang mengandung ikatan antara atom
logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak
termasuk sebagai senyawa organologam. Sebagai contoh suatu alkoksida seperti
(C3H7O4)Ti tidaklah termasuk senyawa organologam, karena gugus organiknya
terikat pada Ti melalui atom oksigen. Sedangkan senyawa (C6H5)Ti(OC3H7)3
adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon
C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa
organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik
dan anorganik.
Reaksi carbolithiation
Sebagai nukleofil, reagen organolithium mengalami reaksi karbolasiasi, di mana ikatan karbon-litium menambah ikatan ganda karbon-karbon atau rangkap tiga, membentuk spesies organolithium baru. Reaksi ini adalah reaksi senyawa organolitik yang paling banyak digunakan. Carbolithiation adalah kunci dalam proses polimerisasi anionik, dan n -butyllithium digunakan sebagai katalis untuk memulai polimerisasi stirena , butadiena, atau isoprena atau campurannya.
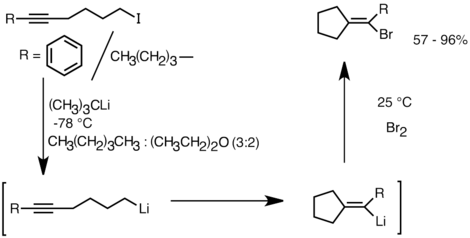
Aplikasi lain yang mengambil keuntungan dari reaktivitas ini adalah pembentukan karboksik dan heterosiklik coumpound melalui carbolithiation intramolekul . Sebagai bentuk siklisasi anionik, reaksi karbolitikasi intramolekul menawarkan beberapa keunggulan dibandingkan dengan siklisasi radikal . Pertama, adalah mungkin untuk spesies siklik organolithium produk bereaksi dengan elektrofil, sedangkan seringkali sulit untuk menjebak intermediet radikal dari struktur yang sesuai. Kedua, siklisasi anionik sering lebih regio- dan stereospesifik daripada siklisasi radikal, terutama dalam kasus 5-hexenyllithiums. Intramolecular carbolithiation memungkinkan penambahan alkil-, vinyllithiummenjadi ikatan rangkap tiga dan ikatan ganda tersubstitusi mono-alkil. Aryllithiums juga dapat mengalami penambahan jika cincin beranggota 5 terbentuk. Keterbatasan carbolithiation intramolekul termasuk kesulitan membentuk 3 atau 4-beranggota cincin, sebagai spesies organiklikum siklik menengah sering cenderung mengalami cincin-bukaan. Di bawah ini adalah contoh reaksi carbolithiation intramolekul. Spesies lithium yang berasal dari pertukaran lithium-halogen disiklisasi untuk membentuk vinyllithium melalui penutupan cincin 5-exo-trig. Spesies vinyllithium selanjutnya bereaksi dengan elektrofil dan menghasilkan senyawa siklopentilidena yang difungsikan.
Selain senyawa karbonil
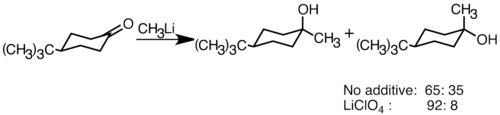
Reagen organolitik nukleofilik dapat menambah ikatan ganda karbida elektrofilik untuk membentuk ikatan karbon-karbon. Mereka dapat bereaksi dengan aldehida dan ketonuntuk menghasilkan alkohol . Penambahan berlangsung terutama melalui penambahan polar, di mana spesies organolitik nukleofilik menyerang dari arah khatulistiwa, dan menghasilkan alkohol aksial. Penambahan garam lithium seperti LiClO 4 dapat meningkatkan stereoselektivitas reaksi.
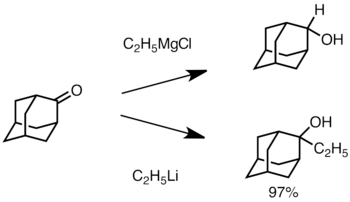
Ketika keton terhambat secara sterik, menggunakan pereaksi Grignard sering menyebabkan reduksi gugus karbonil, bukan penambahan. Namun, reagen alkyllithium cenderung mengurangi keton, dan dapat digunakan untuk mensintesis alkohol tersubstitusi. Di bawah ini adalah contoh dari penambahan ethyllithium ke adamantone untuk menghasilkan alkohol tersier.
Organolithium reagen juga lebih unggul daripada reagen Grignard dalam kemampuannya untuk bereaksi dengan asam karboksilat untuk membentuk keton. Reaksi ini dapat dioptimalkan dengan hati-hati mengontrol jumlah penambahan reagen organolitium, atau menggunakan trimethylsilyl chloride untuk memuaskan pereaksi lithium berlebih. Cara yang lebih umum untuk mensintesis keton adalah melalui penambahan reagen organolitium ke Weinreb amides (N-methoxy-N-methyl amides). Reaksi ini menghasilkan keton ketika pereaksi organolithium digunakan secara berlebihan, karena chelation ion litium antara oksigen N-metoksi dan oksigen karbonil, yang membentuk intermediet tetrahedral yang runtuh pada kerja asam.
Organolithium reagen juga dapat bereaksi dengan karbon dioksida untuk membentuk asam karboksilat .
Dalam kasus substrat enone , di mana dua situs penambahan nukleofilik dimungkinkan (1,2 selain karbon karbonil atau 1,4 konjugat selain karbon β), spesies organolitium yang paling reaktif mendukung tambahan 1,2, namun, ada beberapa cara untuk mendorong reagen organolithium untuk menjalani penambahan konjugasi. Pertama, karena adduct 1,4 kemungkinan adalah spesies yang lebih termodinamik, penambahan konjugasi dapat dicapai melalui equilibrium (isomerisasi dari dua produk), terutama ketika nukleofil lithium lemah dan penambahan 1,2 reversibel. Kedua, menambahkan ligan donor ke dalam reaksi membentuk spesies lithium heteroatom-stabil yang mendukung penambahan 1,4 konjugasi. Dalam satu contoh, penambahan tingkat rendah HMPA ke pelarut mendukung penambahan 1,4. Dengan tidak adanya ligan donor, lithium kation terkoordinasi erat dengan atom oksigen, namun, ketika kation lithium dilarutkan oleh HMPA, koordinasi antara karbonil oksigen dan ion lithium melemah. Metode ini umumnya tidak dapat digunakan untuk mempengaruhi regioselektivitas reagen alkil dan arilithium. [42] [43]
Organolithium reagen juga dapat melakukan penambahan nukleofilik enantioselektif untuk karbonil dan turunannya, sering dengan adanya ligan kiral. Reaktivitas ini secara luas diterapkan dalam sintesis industri senyawa farmasi. Contohnya adalah sintesis Merck dan Dupont Efavirenz , suatu penghambat transcriptase reverse HIV yang poten.Lithium acetylide ditambahkan ke keton prokiral untuk menghasilkan produk alkohol kiral. Struktur intermediet reaksi aktif ditentukan oleh studi spektroskopi NMR dalam keadaan larutan dan kristalografi sinar-X dari keadaan padat menjadi kubik 2: 2 tetramer.
Pertukaran Lithium-Halogen
Pertukaran halogen litium adalah reaksi metatesis antara spesies organohalida dan organolithium. Gilman dan Wittig secara independen menemukan metode ini pada akhir 1930-an.
- ( 2 )
Mekanisme pertukaran lithium-halogen masih diperdebatkan. Satu jalur yang mungkin melibatkan mekanisme nukleofilik yang menghasilkan intermediet "makan-kompleks" yang dapat dibalik. Farnham dan Calabrese mampu mengisolasi "makan-kompleks" lithium bis (pentafluorophenyl) iodinate yang dikomplekskan dengan TMEDA dan memperoleh struktur kristal X-ray. The "makan-kompleks" selanjutnya bereaksi dengan elektrofil dan memberikan pentafluorophenyl iodide dan C 6 H 5 Li. Sejumlah studi kinetik juga mendukung jalur nukleofilik di mana carbanion pada spesies lithium menyerang atom halogen pada aril halida. Mekanisme lain yang mungkin melibatkan transfer elektron tunggal dan generasi radikal. Dalam reaksi alkyllithium sekunder dan tersier dan alkil halida, spesies radikal terdeteksi oleh spektroskopi EPR . Namun, apakah radikal ini merupakan reaksi antara tidak definitif. Studi mekanistik pertukaran lithium-halogen juga rumit oleh pembentukan agregat spesies organolithium.
Tingkat pertukaran halogen lithium sangat cepat. Biasanya lebih cepat daripada penambahan nukleofilik dan kadang-kadang bisa melebihi laju transfer proton. Dalam contoh di bawah ini, pertukaran antara lithium dan iodida primer hampir seketika, dan outcompetes transfer proton dari metanol ke tert -butyllithium. Produk alkena utama terbentuk dalam hasil lebih dari 90%.
Pertukaran litium-halogen sangat berguna dalam mempersiapkan reagen organolithium baru. Nilai tukar biasanya mengikuti tren I> Br> Cl. Alkil dan arilfluorida umumnya tidak bereaksi terhadap reagen organolithium. Pertukaran halogen litium dikontrol secara kinetik, dan tingkat pertukaran terutama dipengaruhi oleh kestabilan intermediet carbanion (sp> sp2> sp3) dari reagen organolithium. Sebagai contoh, reagen organolithium tersier yang paling dasar (biasanya n -butyllithium, sec -butyllithium atau tert -butyllithium) adalah yang paling reaktif, dan akan bereaksi dengan alkil halida primer (biasanya bromida atau iodida) untuk membentuk spesies organolitik yang lebih stabil.Oleh karena itu, pertukaran halogen lithium paling sering digunakan untuk menyiapkan reagen alisllitium vinil-aril dan primer. Pertukaran halogen lithium juga difasilitasi ketika gugus alkoksi atau heteroatom hadir untuk menstabilkan karbanion, dan metode ini sangat berguna untuk persiapan pereaksi lithium berfungsional yang tidak dapat mentolerir kondisi yang lebih keras yang diperlukan untuk reduksi dengan logam lithium. Substrat seperti vinyl halides biasanya mengalami pertukaran lithium-halogen dengan retensi stereokimia dari ikatan rangkap.
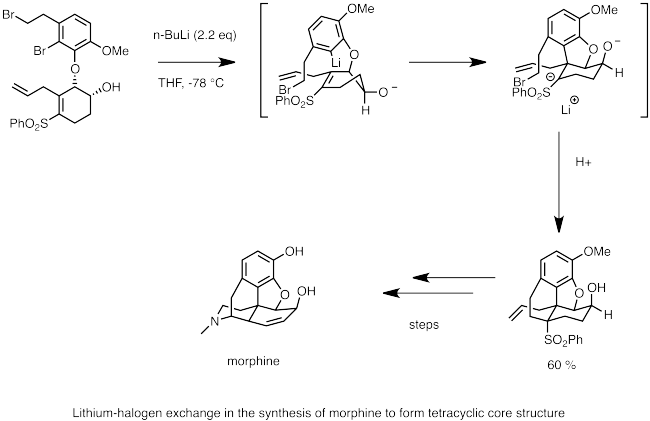
Di bawah ini adalah contoh penggunaan pertukaran lithium-halogen dalam sintesis morfin. Di sini, n -butyllithium digunakan untuk melakukan pertukaran lithium-halogen dengan bromida. Pusat karbion nukleofilik cepat mengalami carbolithiation ke ikatan ganda, menghasilkan anion stabil oleh kelompok sulfon yang berdekatan. Reaksi intramolekul S N 2 oleh anion membentuk tulang punggung morfin siklik.
Pertukaran halogen litium adalah bagian penting dari siklisasi Parham. Dalam reaksi ini, pertukaran aril halida (biasanya iodida atau bromida) dengan organolitium untuk membentuk spesies aren lithiated. Jika arene memikul rantai samping dengan bagian elektrofilik, maka carbanion yang melekat pada litium akan melakukan serangan nukleofilik intramolekul dan siklisasi. Reaksi ini merupakan strategi yang berguna untuk pembentukan heterocycle. Dalam contoh di bawah ini, siklisasi Parham digunakan dalam siklisasi isosianat untuk membentuk isoindolinon, yang kemudian diubah menjadi nitrone. Spesies nitrona selanjutnya bereaksi dengan radikal, dan dapat digunakan sebagai "perangkap berputar" untuk mempelajari proses radikal biologis.
permasalahan
1. bagaimana sifat- sifat senyawa Organologam ?
2. mengapa alkoksida (C3H7O4)Ti tidak termasuk organologam sedangkan (C6H5)Ti(OC3H7)3 merupakan organologam?
3. bagaimana proses reagen organolithium mengalami reaksi karbolasiasi?
Daftar Pustaka
Wikipedia. 2018. Organolithium reagen. tersedia : https://translate.googleusercontent.com/translate_c?depth=1&hl=id&prev=search&rurl=translate.google.com&sl=en&sp=nmt4&u=https://en.wikipedia.org/wiki/Organolithium_compound&xid=17259,15700023,15700124,15700149,15700168,15700186,15700201&usg=ALkJrhgPT5jILMAlytMJWWnfspYjpM2CIw











Baiklah saya desi ratna sari dengan nim A1C116068, akan menjawab permasalahan nomor 1. Organologam dengan yang berikatan secara ionik bersifat tak larut dalam pelarut hidrokarbon dan mudah teroksidasi. Sifat dari senyawa organologam dengan ikatan kovalen ini mudah menguap, larut dalam pelarut organik, dan tidak larut dalam air.
BalasHapusBaiklah saya demiati akan membahas pertanyaan no.3 yang mana jawabanya karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan senyawa (C6H5)Ti(OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
BalasHapusSaya akan mencoba menjawab permasalahan No.4 yaitu :
BalasHapusPertukaran halogen litium dikontrol secara kinetik, dan tingkat pertukaran terutama dipengaruhi oleh kestabilan intermediet carbanion (sp> sp2> sp3) dari reagen organolithium. Sebagai contoh, reagen organolithium tersier yang paling dasar (biasanya n -butyllithium, sec -butyllithium atau tert -butyllithium) adalah yang paling reaktif, dan akan bereaksi dengan alkil halida primer (biasanya bromida atau iodida) untuk membentuk spesies organolitik yang lebih stabil.
Nama saya dolla mulyana harnas dengan nim a1c116080 akan mencoba menjawab nomor 2 suatu alkoksida seperti (C3H7O4)Ti tidaklah termasuk senyawa organologam, karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan senyawa (C6H5)Ti(OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
BalasHapus